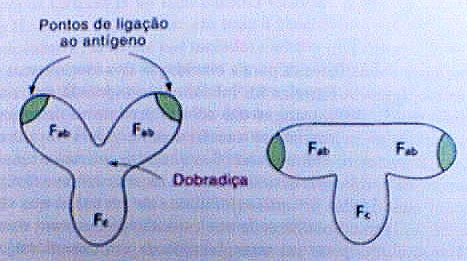
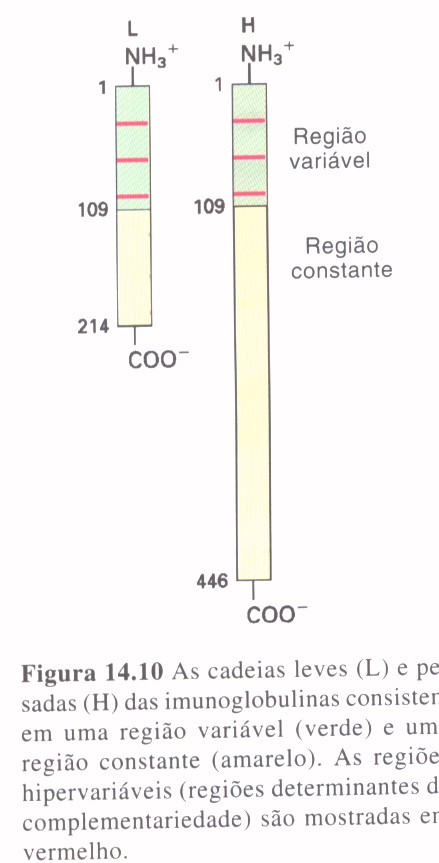
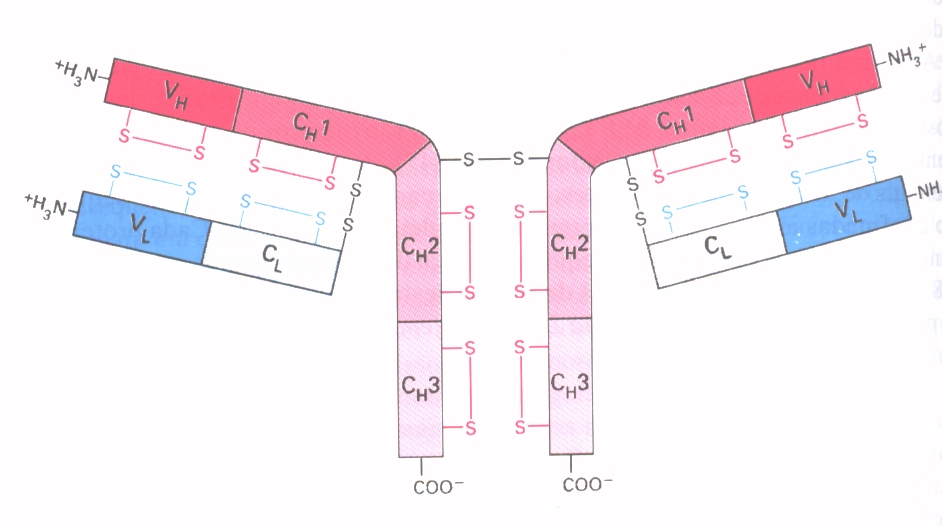
As imunoglobulinas consistem em dois tipos de cadeias polipeptídicas, uma cadeia leve (L) e uma cadeia pesada (H). Cada cadeia L é ligada a uma cadeia H por uma ponte de sulfeto, e as cadeias H são ligadas entre si por pelo menos uma ponte de sulfeto. Tanto a cadeia pesada quanto a cadeia leve consistem em uma região variável e uma região constante. A região variável da cadeia pesada tem o mesmo comprimento que a da cadeia leve, enquanto a região constante é cerca de três vezes maior.
Três segmentos da cadeia leve e três da cadeia pesada apresentam muito mais variabilidade do que os outros aminoácidos nas regiões variáveis destas cadeias. Uma proposição para este fato foi dada por Elvin Kabat em 1970, ele propôs que esses segmentos hipervariáveis formem o local de ligação do antígeno e que a especificidade do anticorpo seja determinada pela natureza de seus aminoácidos. As regiões hipervariáveis são também chamadas de regiões determinantes de complementariedade (CDRs), porque determinam a especificidade do anticorpo.
As imunoglobulinas são enoveladas em domínios compactos, cada um servindo a uma função molecular distinta, além disso estes domínios assemelham-se uns aos outros em estrutura terciária. Assim, uma imunoglobulina humana consiste numa disposição tetraédrica de quatro subunidades globulares, VL, VH, CL e CH, que são extremamente similares em estrutura tridimensional.
Uma característica estrutural comum dos domínios das imunoglobulinas é a presença de dois folhas largas de fitas beta antiparalelas. Muitas cadeias laterais hidrófobas são fortemente envolvidas por estes filamentos, que são unidos por uma ligação de sulfeto. Este tema estrutural repetido é chamado de dobramento de imunoglobulina. Os domínios C (constantes) contêm três fitas beta em uma folha e quatro na oposta. Os domínios V (variáveis) são similares, exceto pela adição de duas fitas beta em uma das alça.
As posições dos CDRs de VL e VH, são características. Essas sequências hipervariáveis, as fontes de especificidade de anticorpos, estão situadas em alças em um final do “sanduiche”. CDR1 emerge da alça entre os filamentos dois e três, e CDR3 entre os filamentos seis e sete. O motivo para os dois filamentos extra do domínio V é agora evidente: a alça entre eles apresenta CDR2.
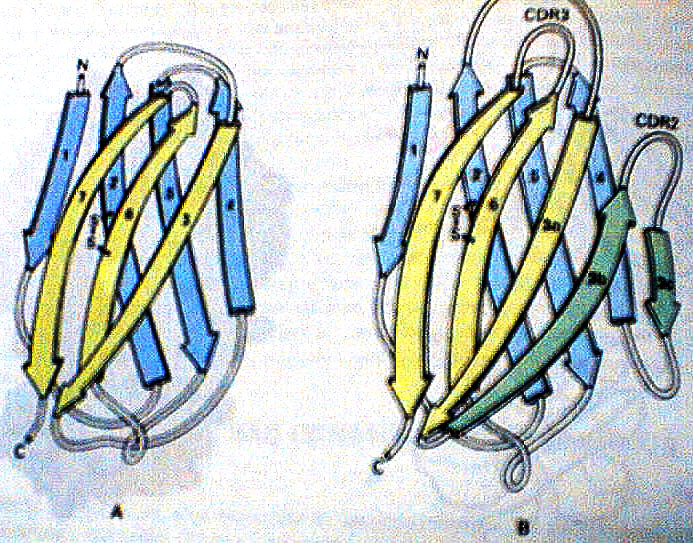
O cerne de imunoglobulina serve como arcabouço que permite uma variação quase infinita das alças. A superposição de estruturas de muitos domínios V diferentes mostra que diversos CDRs emergem de uma estrutura altamente conservada. Além disso, VL e VH se associam de modo que suas CDRs se juntam para formar um local de ligação. Virtualmente qualquer VL pode se parear com qualquer VH. Assim um grande número de pontos diferentes de ligação podem ser construídos por sua associação combinatória.
O número de diferentes tipos de anticorpos que podem ser feitos por um animal é muito grande, pelo menos um milhão. Isto nos leva a pergunta importante: como são produzidas as diferentes sequências da região variável? E quando e como a diversidade é gerada?
O número de genes de região variável na linhagem germinativa é muito pequeno para ser a única fonte de diversidade dos anticorpos. Obviamente, parte desta diversidade deve ser gerada durante o tempo de vida de um animal na diferenciação de seus linfócitos.
A recombinação permite produzir uma extraordinária diversidade de anticorpos a partir de uma quantidade relativamente pequena de capacidade codificadora no DNA. Há duas famílias distintas de cadeias leves chamadas de Kappa e lambda, que diferem nas sequëncias de suas regiões contantes. Para cada um dos três tipos de cadeias polipeptídicas (cadeia pesada, cadeia leve Kappa e cadeia leve lambda), a diversidade nas regiões variáveis é gerada por um mecanismo semelhante a recombinação. Os genes para esses polipeptídios estão divididos em segmentos e agregados contendo versões múltiplas de cada segmento existente no genoma. Uma versão de cada segmento é unida para criar um gene completo.
O segmento V codifica os primeiros resíduos de aminoácidos da região variável, o segmento J codifica os aminoácidos restantes e o segmento C codifica a região constante. Há vários segmentos V e J diferentes. A medida que uma célula tronco na medula óssea se diferencia para formar um linfócito B maduro, um V e um J são aproximados pela recombinação sítio-específica. A união final desta combinação V-J a região C é acompanhada por uma reação de processamento do RNA depois da transcrição. Além disso uma diversidade adicional é gerada pelo fato das sequências V estarem sujeitas a altas taxas de mutação durante a diferenciação do linfócito B.